- · 《上海交通大学学报》栏[09/30]
- · 《上海交通大学学报》数[09/30]
- · 《上海交通大学学报》收[09/30]
- · 《上海交通大学学报》投[09/30]
- · 《上海交通大学学报》征[09/30]
- · 《上海交通大学学报》刊[09/30]
上海交通大学夏小霞:双重热敏蛋白水凝胶的按
作者:网站采编关键词:
摘要:【科研摘要】 尽管在热敏蛋白水凝胶方面取得了很大进展,但是由于复杂的分子结构和基础蛋白聚合物之间的相互作用,调节其热转变仍然是一个挑战。最近, 上海交通大学 夏小霞副
【科研摘要】
尽管在热敏蛋白水凝胶方面取得了很大进展,但是由于复杂的分子结构和基础蛋白聚合物之间的相互作用,调节其热转变仍然是一个挑战。最近,上海交通大学夏小霞副教授团队报告了报告了一种遗传融合策略,可调节蜘蛛主要壶腹蜘蛛蛋白1的C端结构域(CTD)的独特双重热转变,并通过生物物理表征和分子动力学模拟探索调节机制。

作者发现,通过引入低温下的额外氢键和高温下的疏水相互作用,弹性蛋白样多肽(ELP)的融合将CTD的双重转变温度调节至生理相关的窗口。由融合蛋白构建的所得水凝胶被证明是用于细胞保存和递送的有前途的载体。这项研究提供了对双重热敏蛋白水凝胶的调节的见解,并提出了水凝胶在巩固细胞存储和递送中的潜在应用。相关论文以题为On-Demand Regulation of Dual Thermosensitive Protein Hydrogels发表在《ACS Macro Letter》上。
【主图】
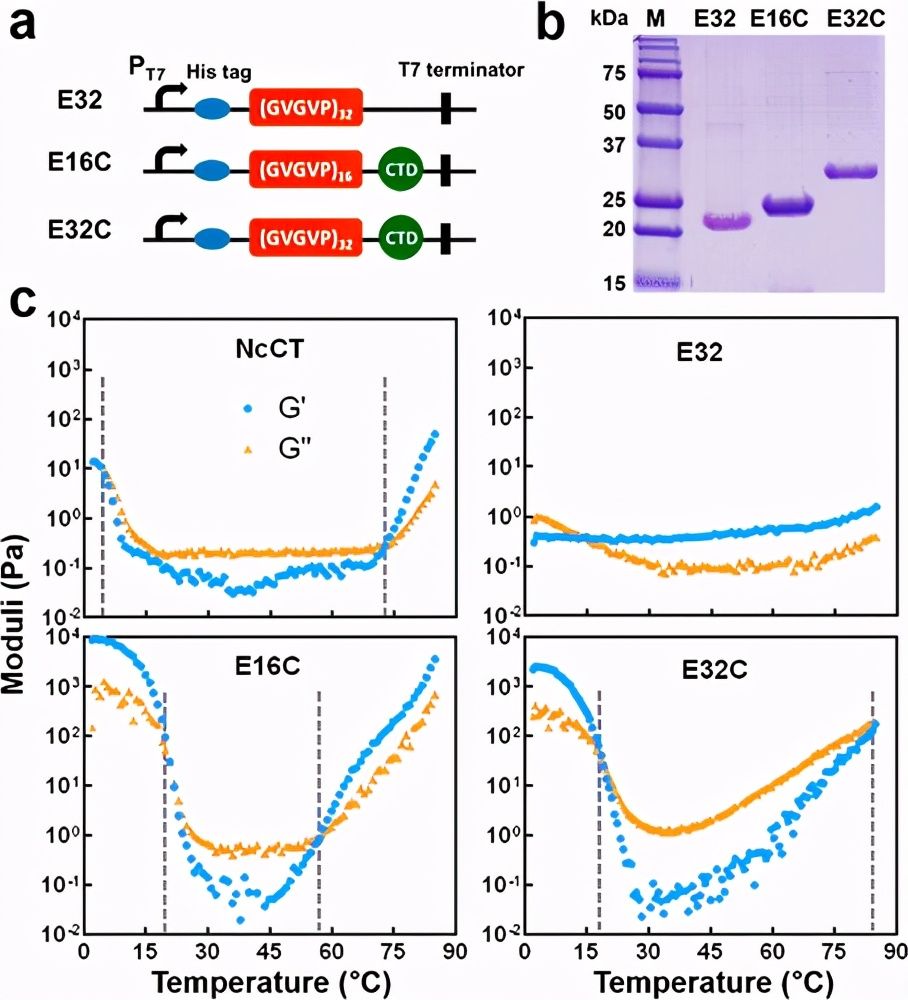
图1.双重热敏凝胶的调节。
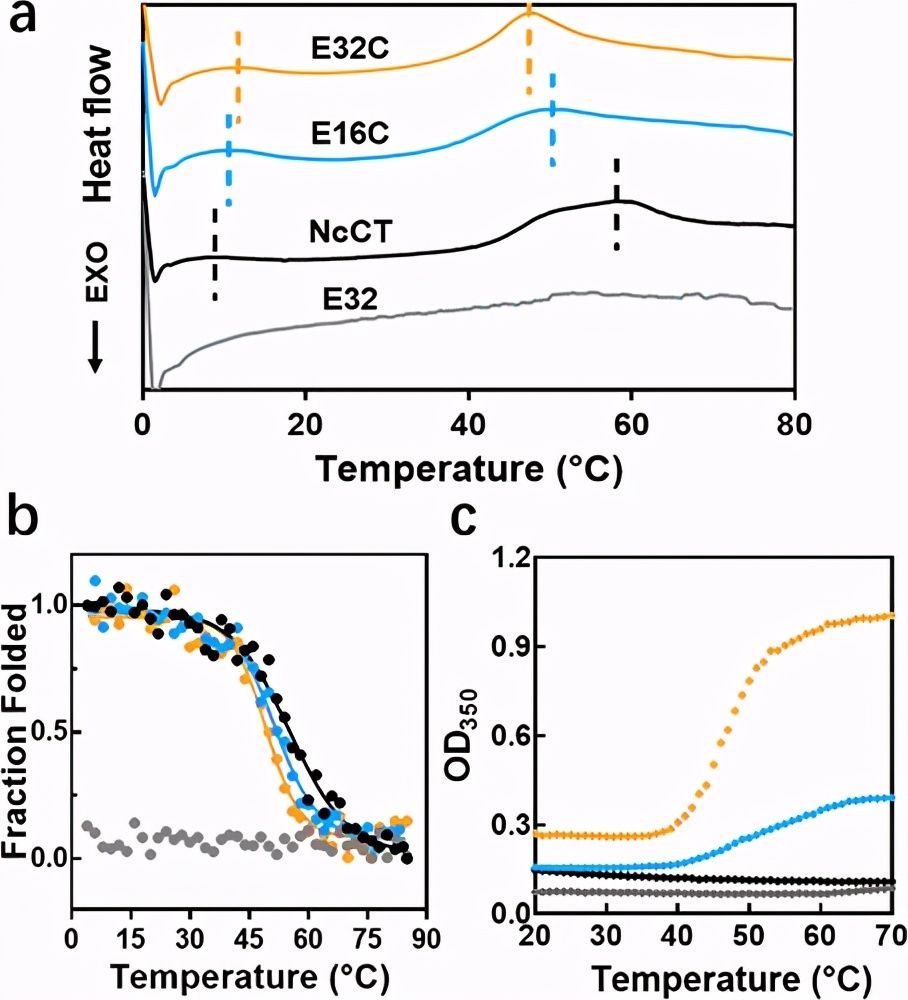
图2. NcCT,E32,E16C和E32C的热转变和聚集。
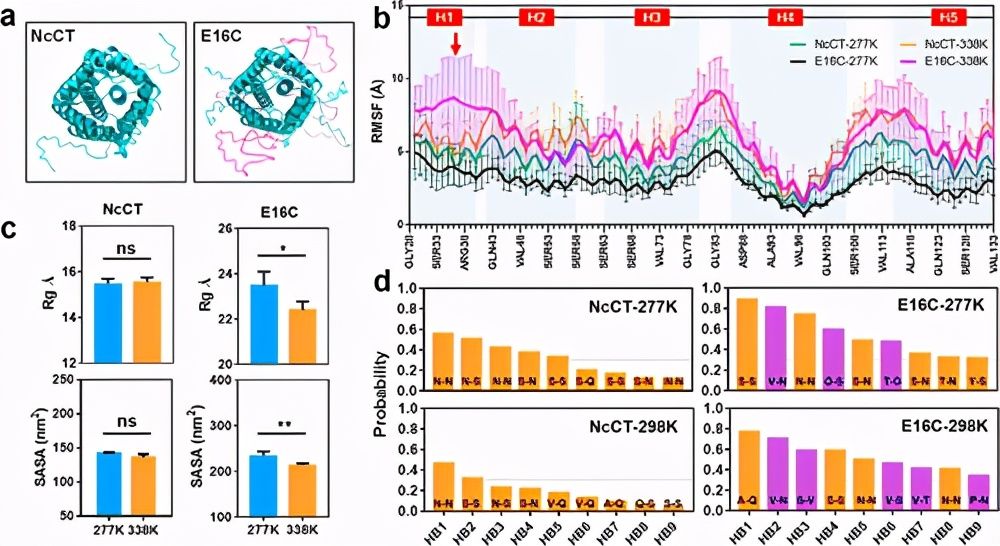
图3. NcCT和E16C的分子动力学模拟。
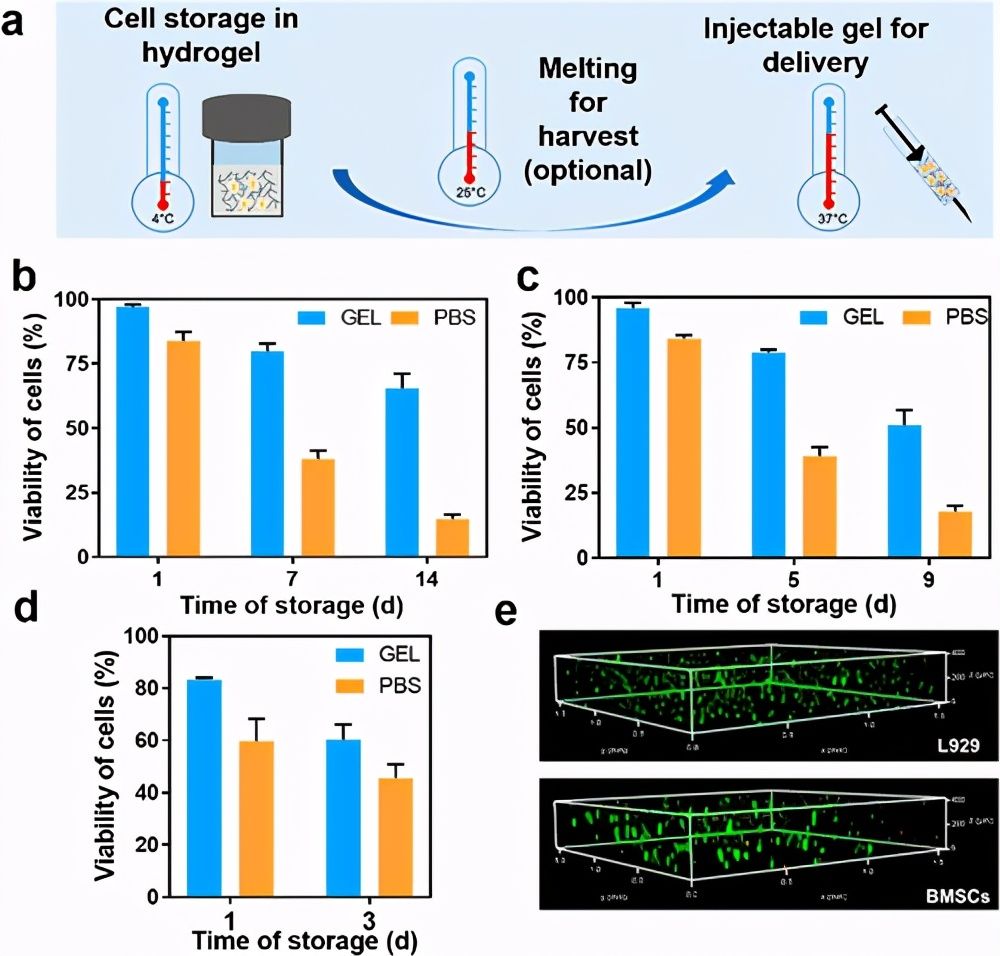
图4.双重热敏蛋白水凝胶的应用演示。
【总结】
团队开发了一种遗传融合策略来调节CTD的独特双重热敏凝胶化,并且概念验证证明了其在合并细胞存储和递送中的可能应用。此外,还基于生物物理表征和分子动力学模拟揭示了水凝胶形成和调控的机理。ELP具有适当长度的融合引入了额外的氢键相互作用,从而有利于高温下的UCST凝胶化,并通过热增强的疏水性相互作用促进了CTD的展开,从而使低温下的LCST凝胶化成为可能。这些发现为其他蛋白质水凝胶的设计和调节提供了启发,并且所提出的整合细胞存储和递送策略为应对细胞疗法中的重大后勤挑战提供了令人兴奋的机会。
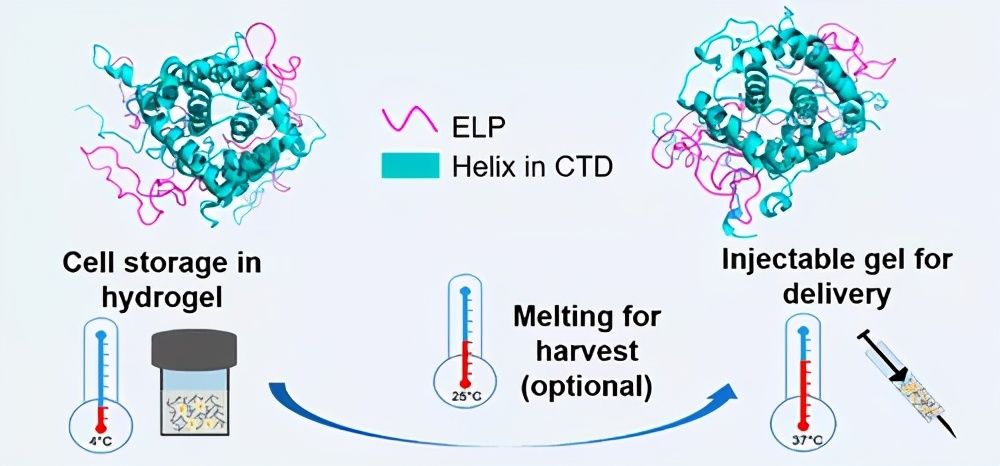
TOC
参考文献:doi.org/10.1021/acsmacrolett.1c00062
文章来源:《上海交通大学学报》 网址: http://www.shjtdxxb.cn/zonghexinwen/2021/0329/640.html